医疗器械公司如何应对欧盟最新法规框架下的网络技术服务要求

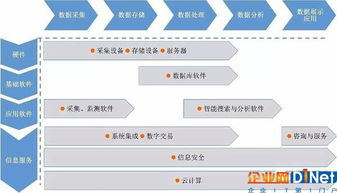
随着欧盟对医疗器械监管的不断升级,特别是MDR(医疗器械法规)和IVDR(体外诊断器械法规)的全面实施,网络技术服务已成为医疗器械合规的重要组成部分。这些法规不仅关注设备本身的安全性和有效性,还特别强调了网络安全、数据保护和软件生命周期管理。医疗器械公司需要采取以下策略来有效应对欧盟的最新法规要求:
- 全面理解法规要求:公司必须深入研究MDR和IVDR中与网络技术服务相关的条款,特别是附件一中的通用安全与性能要求。这包括对网络安全风险的管理、数据隐私保护(如符合GDPR)、软件验证与确认以及售后监督系统的建立。建议与专业法律顾问或认证机构合作,确保对法规的准确解读。
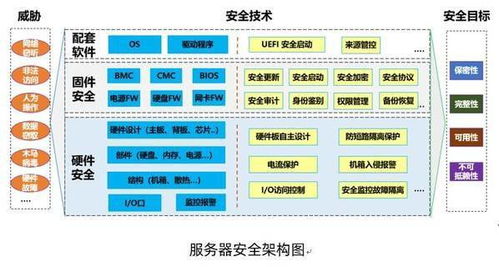
- 实施网络安全风险管理:根据欧盟法规,医疗器械必须集成网络安全措施,防止未授权访问、数据泄露和恶意攻击。公司应建立全面的风险管理体系,包括威胁建模、漏洞评估和渗透测试。对于联网设备,还需确保软件更新机制安全可靠,并制定应急响应计划以应对潜在事件。
- 强化数据保护与合规:网络技术服务常涉及患者数据的处理,因此必须严格遵守GDPR等数据保护法规。公司需实施数据加密、匿名化技术,并确保数据跨境传输的合法性。应建立透明的数据政策,告知用户数据使用方式,并获得必要的同意。
- 优化软件开发生命周期:欧盟法规强调软件作为医疗器械(SaMD)的监管,要求在整个生命周期中确保其安全性和性能。公司应采用敏捷或V模型开发流程,集成验证与确认活动,并保持详细的文档记录。使用符合标准(如IEC 62304)的开发工具和方法,可以简化合规流程。
- 加强供应链与合作管理:网络技术服务往往依赖第三方供应商,如云服务提供商或软件开发伙伴。公司必须对这些合作伙伴进行严格审核,确保其符合欧盟法规要求。签订明确的合同条款,规定网络安全责任和数据处理义务,以避免合规风险。
- 投资于人员培训与技术升级:员工是合规的关键。公司应为研发、质量和法务团队提供定期培训,内容涵盖欧盟法规更新、网络安全最佳实践和数据处理规范。投资先进的技术解决方案,如自动化测试工具和监控系统,以提高效率和合规性。
- 主动参与监管沟通与认证:尽早与公告机构沟通,获取关于网络技术服务的预审意见,可以加快认证流程。公司还应参与行业论坛和标准制定组织,跟踪EN ISO 14971等相关标准的更新,确保实践与法规同步。
应对欧盟最新法规的网络技术服务要求,医疗器械公司需采取综合策略,将网络安全和数据保护融入产品设计和运营全流程。通过主动合规、持续监控和创新技术应用,企业不仅能满足监管要求,还能提升市场竞争力,赢得用户信任。
如若转载,请注明出处:http://www.yinzhenyun.com/product/3.html
更新时间:2026-01-15 23:50:47